Kako funkcioniše litijum-jonska baterija za električno vozilo?
Пошто смо у другом чланку видели рад оловне батерије којом су опремљени сви аутомобили, погледајмо сада принцип рада електричног аутомобила и посебно његове литијумске батерије...

Принц
Као и код било које врсте батерија, принцип остаје исти: наиме, да се генерише енергија (овде електрична енергија) кроз хемијску или чак електричну реакцију, јер је хемија увек блиска електрицитету. У ствари, сами атоми су направљени од електрицитета: то су електрони који круже око језгра и који на неки начин формирају „љуску“ атома, или чак његову „кожу“. Знајући такође да су слободни електрони лебдећи комадићи коже који проводе своје време крећући се од једног атома до другог (без везивања за њега), ово је случај само за проводне материјале (зависи од броја слојева електрона и броја електрона по последњи пројектил).
Затим ћемо узети "комад коже" атома (дакле и део његове струје) кроз хемијску реакцију да бисмо произвели електричну енергију.

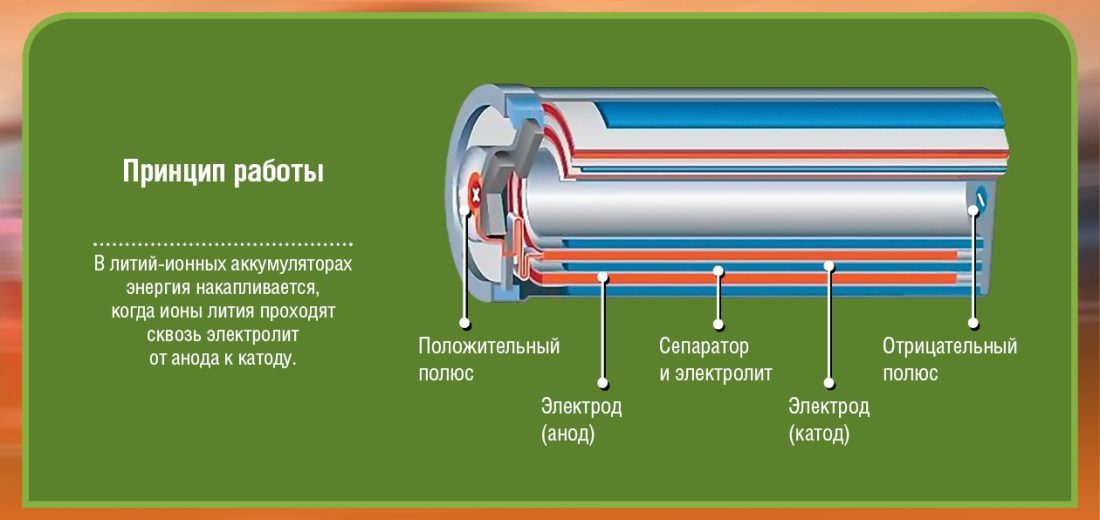
основе
Пре свега, постоје два пола (електроде) које називамо катода (+ терминал: у литијум кобалт оксиду) и anoda (терминал -: угљеник). Сваки од ових полова се састоји од материјала који или одбија електроне (-) или привлачи (+). Све је поплављено електролит што ће омогућити хемијску реакцију (пренос материјала са аноде на катоду) која резултира стварањем електричне енергије. Између ове две електроде (аноде и катоде) поставља се баријера да би се избегли кратки спојеви.
Имајте на уму да се батерија састоји од неколико ћелија, од којих је свака формирана оним што је видљиво на дијаграмима. Ако, на пример, акумулирам 2 ћелије од 2 волта, излаз моје батерије ће бити само 4 волта. Да бисте померили машину тешку неколико стотина кг, замислите колико ћелија је потребно...
Шта се дешава на полигону?
Десно су атоми литијума. Они су детаљно представљени: жуто срце представља протоне, а зелено срце представља електроне око којих круже.
Када је батерија потпуно напуњена, сви атоми литијума су на страни аноде (-). Ови атоми се састоје од језгра (састављеног од неколико протона) који имају позитивну електричну силу од 3 и 3 електрона који имају негативну електричну силу од 1 (укупно 3 јер је 3 Кс 1 = 3). . Дакле, атом је стабилан са 3 позитивна и 3 негативна (не привлачи нити одбија електроне).
Уклањамо електрон из литијума, који на крају има само два: тада га привлачи + и пролази кроз преграду.
Када успоставим контакт између + и – терминала (па када користим батерију), електрони ће се кретати од – терминала до + терминала дуж електричне жице ван батерије. Међутим, ови електрони потичу из „длаке“ атома литијума! У суштини, од 3 електрона који круже около, 1 се одбацује и атому остаје само 2. Одједном, његова електрична сила више није уравнотежена, што такође изазива хемијску реакцију. Имајте на уму и да атом литијума постаје литијум јон+ јер је сада позитивно (3 – 2 = 1 / Језгро вреди 3 а електрони су 2 пошто смо изгубили један. Сабирање даје 1, а не 0 као раније. Дакле, више није неутрално).
Хемијска реакција која је резултат неравнотеже (након разбијања електрона да би се створила струја) имаће ефекат слања литијум јон + до катоде (+ терминала) кроз зид дизајниран да изолује све. На крају, електрони и јони + завршавају на + страни.
Када се реакција заврши, батерија се празни. Сада постоји баланс између + и - терминала који сада спречава струју. У суштини, принцип је да се изазове депресија на хемијском/електричном нивоу како би се створила електрична струја. Можемо је замислити као реку, што је више нагнута, то ће бити важнији интензитет текуће воде. С друге стране, ако је река равна, више неће тећи, што значи да је батерија празна.
Допунити?
Допуњавање се састоји од преокретања процеса убризгавањем електрона у - и одстрањивања више тако што их усисава (мало као допуњавање реке да би могла поново да тече). Тако се све у батерији враћа онако како је било пре пражњења.
У основи, када празнимо користимо хемијску реакцију, а када се пунимо враћамо оригиналне ствари (али за то вам је потребна струја, а самим тим и станица за пуњење).
Носити?
Литијумске батерије се троше брже од добрих старих оловних батерија које су вековима коришћене у нашим аутомобилима. Електролит има тенденцију распадања, као и електроде (анода и катода), али треба узети у обзир и да се на електродама ствара талог који смањује прелазак јона са једне на другу страну... Специјални уређаји омогућавају да регенеришете истрошене батерије тако што ћете их испразнити на посебан начин.
Број могућих циклуса (пражњење + потпуно пуњење) се процењује на отприлике 1000-1500, дакле са полу-циклусом при пуњењу од 50 до 100% уместо 0 до 100%. ТОПЛОТА такође у великој мери оштећује литијум-јонске батерије, које имају тенденцију да се загреју када се из њих повуче превише енергије.
Прочитајте такође: Како да сачувам батерију у свом електричном аутомобилу?
Снага мотора и батерија...
За разлику од термовизира, резервоар за гориво не утиче на снагу. Ако имате мотор од 400 КС, онда вам резервоар од 10 литара неће спречити да добијете 400 КС, чак и ако је то на веома кратко време... За електрични аутомобил ово уопште није исто! Ако батерија није довољно снажна, мотор неће моћи да ради пуном снагом... То је случај са неким моделима где мотор никада не може да се гурне до своје границе (осим ако се власник не петља и не дода батерију великог калибра !).
Сада хајде да сазнамо: како функционише ЕЛЕКТРОМОТОР
Сви коментари и реакције
последњи коментар је објављен:
Мао (Датум: 2021, 03:03:15)
veoma dobar posao
Ил Ј. 1 реакције на овај коментар:
- Админ АДМИНИСТРАТОР СИТЕ -а (2021-03-03 17:03:50): Овај коментар је још бољи 😉
(Ваш пост ће бити видљив испод коментара након верификације)
Напишите коментар
Шта мислите о подацима о потрошњи које су објавили произвођачи?
